新闻资讯
老鼠解剖:实验大鼠小鼠的肉体剖检诊断及有机组织样品采集视频
上期介绍了两种采血的方法,这周为大家介绍小鼠的组织采样,希望对大家的日常实验工作有所帮助。以下视频由ChristinaM. Parkinson等人制作。

对实验动物进行安乐死后,对动物进行剖检并采集关键脏器组织的样品能够帮助病理诊断及确定疾病感染原因,并且好的样品采集方法能够保障后续的病理诊断。我们本期的推文就是介绍如何进行大小鼠剖检及组织样品采样,其中重点介绍四种比较难的器官组织样品采集方法,包括:肺脏、大脑、肠系膜淋巴结和用于感染因子鉴定的呼吸道内容物。
以下为采样步骤:
一. 剖检
-
对相关动物信息和外观检查的描述是动物剖检的重要组成部分。
-
详细的背景信息对后续的组织病理学的解读非常重要。
-
准确描述安乐死前所观察到的动物的状况。
-
对安乐死的实验动物进行称重和其它测量。
-
必要时可采用录像等信息记录方式。
-
遵守安乐死与化学用品使用SOP。
二. 安乐死后心脏,肺脏,肝脏,肾脏和脾脏的检查
-
在动物安乐死前准备必要的实验用品。
-
简要评估动物的状况、行为和运动。观察并记录包括呼吸模式(例如:快、浅等)以及走动能力和步态(例如:跛行、盘旋、震颤等)。
-
根据所在机构的SOP对动物实施安乐死。
-
评估动物的体表。
-
检查所有外部孔道(耳朵、眼睛、鼻子、肛门、生殖器开口和口腔)。如需更仔细的检查可使用使用解剖镜。
-
将安乐死后的大小鼠以仰卧位放在干净的解剖板或工作台上。
-
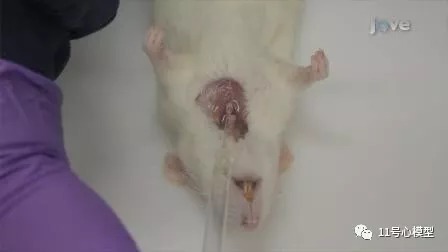
使用剪刀,从肛门到下巴切开皮肤并切开腹壁,暴露腹部脏器,唾液和包皮/阴核腺,以及颈部和腋窝淋巴结。切开胸腔,露出并检查胸腔内脏器,在胸腔两侧横向上方切两个切口,然后在胸骨顶部横向切开胸腔,打开足够宽的空间,彻底检查肺的左右肺叶。
-
检查肌肉骨骼外观结构。
-
评估所检器官的异常情况。
-
观察胃肠道内容物,特别注意病变的胃肠道,肿块和/或出血。
-
检查泌尿生殖系统,检测堵塞、液囊、出血或其他异常情况。
三. 剖检后收集心脏、肝脏、肾脏和脾脏以进行组织病理学检查
-
准备大小适合贴好标签的容器并装入适量的10%中性福尔马林溶液备用。
-
将安乐死后的大小鼠以仰卧位置于干净的解剖板上并暴露目标组织。
-
用镊子和剪刀从剪取目标组织。
-
修剪组织去除脂肪和不必要的结缔组织。
-
将组织放入装有10%中性福尔马林溶液的容器中。
四. 肺组织收集和灌注
-
准备大小适合贴好标签的容器并装入适量的10%中性福尔马林溶液备用。
-
将安乐死后的大小鼠以仰卧位放在干净的解剖板或工作台上。
-
暴露气管、心脏和肺部。
-
使用剪刀和镊子去除覆盖腹侧胸部和颈部区域的皮肤和肌肉。
-
使用剪刀和镊子在胸腔的两侧把肋骨边缘打开,以暴露心脏和肺部的胸腔,然后穿过锁骨附近的一个切口以打开足够宽的空间以彻底检查左右肺叶。
-
切除从胸骨和肋骨延伸到下颌的颈部肌肉。
-
在肋骨的前缘下方插入剪刀,并在两侧各做一次切口,以去除覆盖气管的骨头部分。
-
用钳子抓住下颚附近的气管,用钳子放在钳子上方,完全切开气管。
-
使用镊子轻轻向上拉气管,用剪刀剪断腹侧组织连接,直到整个胸部组织从体内移除。
-
将肺部平放在工作台面上。
-
在气管周围系上一根线但不拉紧。
-
在注射器中注入固定液并连接一根小到足以进入气管的针头。
-
将针头插入气管开口,用钳子夹住针头周围的气管。开始用固定剂慢慢填充肺部。
-
填充肺部直至完全充气。
-
从气管上取下针头。
-
收紧气管周围的缝线材料或绳子,以防止固定液从肺部回流。
-
将充气的肺置于固定液中,固定液与组织的比例约为20:1。
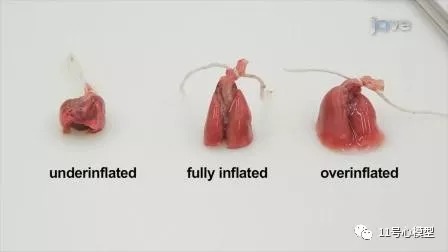
五. 大脑的采集
-
准备大小适合贴好标签的容器并装入适量的10%中性福尔马林溶液备用。
-
将安乐死后的大小鼠以仰卧位放在干净的解剖板或工作台上。
-
使用剪刀和镊子去除覆盖在颅骨上的皮肤和肌肉。
-
用剪刀将头部完整取下。
-
使用小剪刀将底部插入枕骨,并沿颅骨的中线向上切割。
-
使用镊子,反射颅骨暴露大脑的两半。
-
轻轻颠倒头骨,有助于脑组织脱出。
-
使用弯曲的镊子,小心地沿着大脑的外缘和大脑下方滑动镊子,剔除多余的组织和神经使大脑与头骨分离。
-
使用大约20:1的组织与固定剂的比例将大脑置于固定剂中。
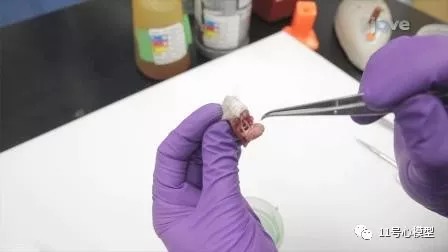
六. 肠系膜淋巴结的收集
-
采集前对器械进行高温高压消毒。
-
准备无菌冻存管和无菌剪刀、镊子。
-
将安乐死后的大小鼠仰卧位放在干净的解剖板或工作台上。
-
使用消毒的剪刀和镊子将腹侧腹壁从生殖器区切割到胸腔底部,去除皮肤和肌肉并暴露肠道。
-
肠系膜淋巴结沿着结肠位于肠系膜组织的腹腔中,紧邻盲肠。
-
找到盲肠后定位肠系膜淋巴结。肠系膜淋巴结位于与盲肠相邻的结肠的肠系膜中。
-
使用无菌操作和无菌器械摘取肠系膜淋巴结并放入标记的冻存管中。
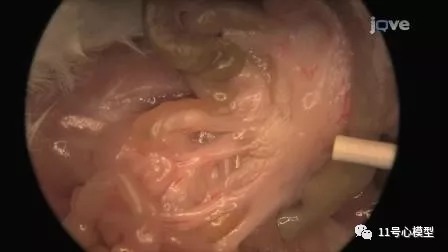
七. 呼吸道吸出物的收集
1.准备所需实验用品,包括无菌移液器、无菌剪刀和镊子、无菌冲洗液及无菌工作台。
2. 将安乐死后的大小鼠以仰卧位放在干净的解剖板或工作台上。
3.可通过气管或鼻咽道继续吸取。
4.大鼠推荐应用气管通道方法,操作如后。
-
剪开颈部皮肤暴露皮下组织。
-
去除唾液腺和颈部肌肉组织暴露气管。
-
使用无菌器械,切开气管以进入管腔。在整个收集过程中保持无菌(转到步骤6)。
5.小鼠推荐应用鼻咽通道(鼻吸出物和支气管吸出物,由于气管尺寸较小):
a.可以对鼻吸出物和支气管吸出物进行该过程。
b.使用火焰灭菌或高压灭菌器械,切断颞下颌(下颌)关节,露出鼻咽口。
6. 将约1ml的取样液吸入无菌移液管中。(转步骤7或8,具体取决于收集的吸气物。)
7. 支气管吸出物:无菌地将移液管插入气管腔并将取样液慢慢注入支气管和肺部。将取样液从支气管和肺中抽出,取出移液管,从移液管中取出取样液。
8. 鼻吸气:
无菌地将移液管插入鼻咽管(小鼠)或气管腔(大鼠),进行头部定向,并将取样液缓慢注入鼻腔。
-
确保通过鼻腭与移液管尖端的接触,或通过观察进入腔内的液体,在鼻孔可见的液体来到达鼻腔。
-
将取样液从鼻腔抽出到移液管中,取出取样液。
9. 无菌地将样品转移到适当的培养基或容器中进行测试。
八. 以下为小鼠解剖脏器分布图
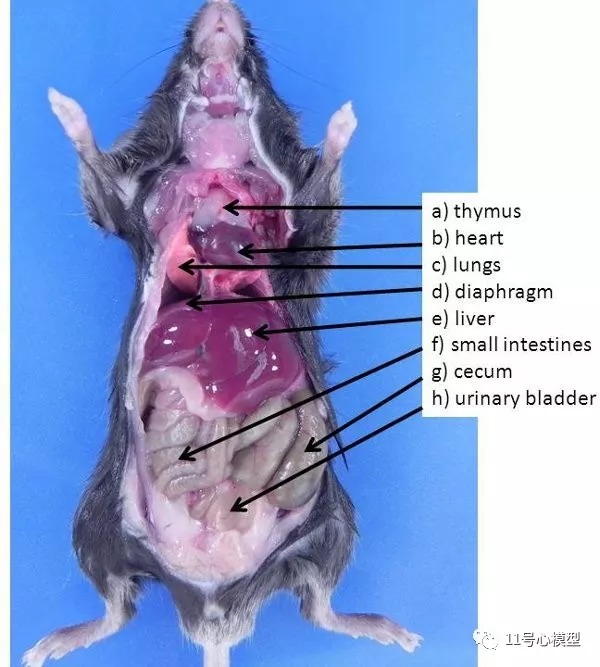
图1. 小鼠的腹部和胸部器官。a)胸腺,b)心脏,c)肺,d)横膈膜,e)肝脏,f)小肠,g)盲肠,h)膀胱。
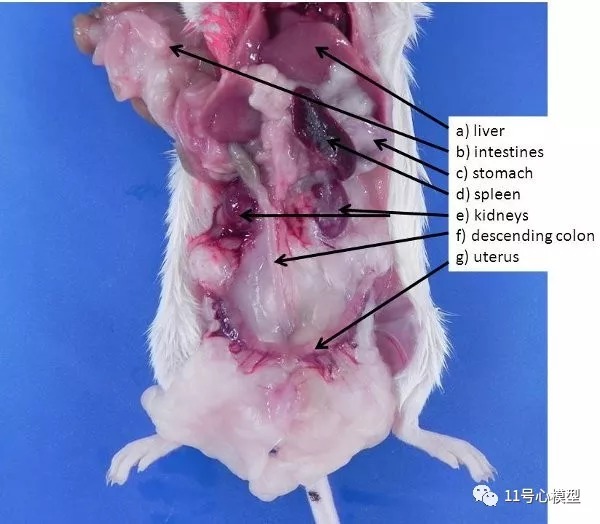
图2. 小鼠腹部和腹膜后器官。将肠和肝脏抬起并移动(或移除),可以看到以下器官。 a)肝脏,b)肠,c)胃,d)脾脏,e)肾脏,f)降结肠,g)子宫。
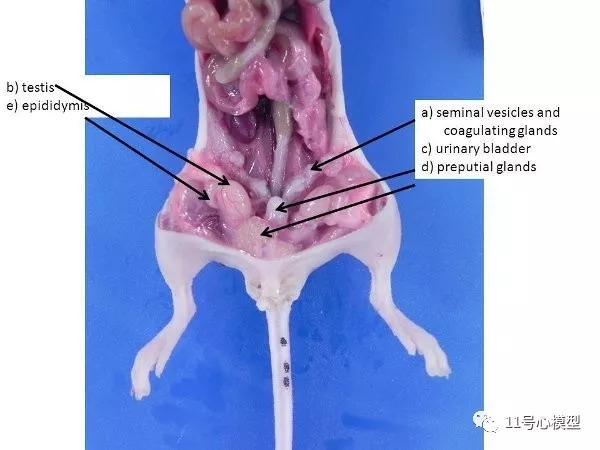
图3. 雄性生殖器官。 a)精囊和凝固腺体,b)睾丸(从阴囊通过腹股沟环推入腹腔,在小鼠和大鼠中保持开放),c)膀胱,d)包皮腺,e)附睾。
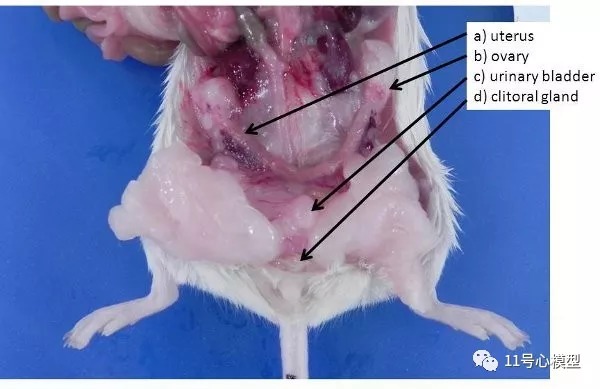
图4. 雌性生殖器官。 a)非妊娠子宫(小鼠和大鼠有双子宫角)b)卵巢,埋在卵巢脂肪垫中,c)膀胱,d)阴核腺。
为便于大家的学习,我还为大家准备相关视频
如果大家有什么想了解的实验技术方法,请留言。我们将尽最大的努力找到相关的教材资料,满足大家的要求。更多详细内容,可点击阅读原文。谢谢!